Малеиновая кислота
| Малеиновая кислота | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
цис-бутендиовая кислота |
| Традиционные названия | малеиновая кислота |
| Хим. формула | HOOC-CH=CH-COOH |
| Рац. формула | H4C4O4 |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 116,07 г/моль |
| Плотность | 1,59 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 135 °C |
| • разложения | 135 °C |
| • вспышки | 127 °C |
| Химические свойства | |
| Константа диссоциации кислоты [math]\displaystyle{ pK_a }[/math] |
pka1 = 1,9 pka2 = 6,07 |
| Растворимость | |
| • в воде | 78,8 г/100 мл |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Малеи́новая кислота́ — органическое соединение с формулой HOOC-CH=CH-COOH. Двухосновная непредельная кислота.
Название по номенклатуре IUPAC — цис-бутендиовая кислота. Её транс-изомер называется фумаровой кислотой.
Соли и сложные эфиры малеиновой кислоты называются малеаты.
Наиболее часто она используется для получения фумаровой кислоты.
Физические свойства
Молекула малеиновой кислоты менее стабильна чем фумаровой кислоты. Разница их теплот сгорания равна 22,7 кДж/моль[1].
Малеиновая кислота хорошо растворима в воде (78,8 г/л при 25 °C), а фумаровая кислота — плохо (6,3 г/л при 25 °C). Эти свойства объясняются образованием внутримолекулярной водородной связи в молекуле малеиновой кислоты.
История и методы синтеза
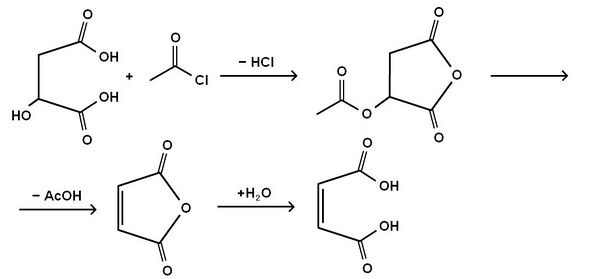
Малеиновая кислота впервые была получена Лассэнем в 1819 г. перегонкой яблочной кислоты. По Перкину (1881 г.), для её получения яблочную кислоту обрабатывают ацетилхлоридом, получая ацетил-яблочный ангидрид, который разлагается с образованием уксусной кислоты и малеинового ангидрида, гидратацией которого получают малеиновую кислоту.
Общая схема процесса:
Производство в промышленности
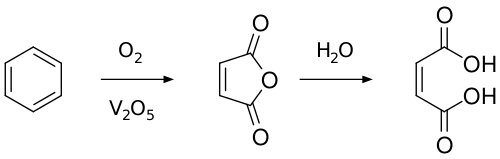
В промышленности малеиновую кислоту получают гидролизом малеинового ангидрида, который получают каталитическим окислением бензола по схеме:
Применение в промышленности
Наиболее важным применением малеиновой кислоты является использование её в производстве фумаровой кислоты. Для производства фумаровой кислоты малеиновою кислоту каталитически (катализаторы — тиомочевина, неорганические кислоты) изомеризуют. Очень малая растворимость фумаровой кислоты сильно упрощает её отделение от непрореагировавшей малеиновой кислоты. Эти кислоты являются геометрическими изомерами, они не могут самопроизвольно превращаться одна в другую. Это объясняется тем, что для их взаимопревращение нужно разорвать π связь между атомами углерода. Путём озонолиза малеиновую кислоту превращают в глиоксиловую кислоту.
Другие реакции
Малеиновою кислоту можно превратить в яблочную кислоту путём гидратации, в янтарную кислоту путём гидрирования или электрохимического восстановления на катоде из нержавеющей стали, в малеиновый ангидрид путём дегидратации. Вышеперечисленные реакции не используются в промышленности для производства перечисленных веществ, потому что они являются экономически невыгодными.
Ссылки
- ↑ Maleic Anhydride, Maleic Acid, and Fumaric Acid Архивная копия от 2 ноября 2013 на Wayback Machine, Huntsman Petrochemical Corporation
Для улучшения этой статьи желательно: |